 Widok zawartości stron
Widok zawartości stron
 Widok zawartości stron
Widok zawartości stron
 Widok zawartości stron
Widok zawartości stron
Sepsa badana na żywo

Opracowany przez naukowców z Kanady i badaczkę z UJ nowy model badań nad sepsą wykorzystany został do analizy specyficznych procesów unieszkodliwiających patogeny
Dr hab. Elżbieta Kołaczkowska z Zakładu Immunologii Ewolucyjnej Uniwersytetu Jagiellońskiego, we współpracy z zespołem prof. Paula Kubesa z Uniwersytetu Calgary w Kanadzie, prowadzi badania nad sepsą antybiotykoporną. Koncentruje się w nich na analizie sieci neutrofilowych, unieszkodliwiających patogeny. Wyniki tych badań właśnie opublikowało prestiżowe czasopismo „Nature Communications".
MRSA – podstępna bakteria
Dr hab. Elżbieta Kołaczkowska z Zakładu Immunologii Ewolucyjnej Uniwersytetu Jagiellońskiego wraz z zespołem prof. Paula Kubesa z Uniwersytetu Calgary w Kanadzie stworzyła nowatorski model badań nad sepsą antybiotykoporną i wykorzystała go do analiz sieci neutrofilowych, unieszkodliwiających patogeny. Wyniki tych badań właśnie opublikowało prestiżowe czasopismo „Nature Communications".
Sepsa czyli posocznica to ogólnoustrojowe zapalenie rozwijające się najczęściej po wniknięciu patogenów (bakterii, wirusów, grzybów) do krwi. Rozwój sepsy jest niebezpieczny dla organizmu i skutkuje bardzo wysoką śmiertelnością sięgającą nawet 30% (umiera 1 na 3 chore osoby). Wynika to z uszkodzeń wielonarządowych (płuc, nerek, wątroby) spowodowanych albo przez toksyny wydzielane przez patogen, a jeszcze częściej przez maksymalnie zaktywowane do jego zniszczenia mechanizmy obronne naszego własnego organizmu (zgodnie z zasadą „gdzie drwa rąbią, tam wióry lecą"). Ponadto osoby, które przeżyją sepsę zmagają się przez resztę życia z jej skutkami, np. amputacjami kończyn.
W leczeniu sepsy jednymi z najważniejszych leków są antybiotyki mające wyeliminować patogeny. Poważne trudności pojawiają się, gdy patogen jest na nie odporny, nie ma wtedy wielu innych możliwości leczenia. Przykładem takiego wyjątkowo problematycznego patogenu jest bakteria - gronkowiec złocisty, a zwłaszcza gronkowiec złocisty oporny na metycylinę i inne pochodne antybiotyki (ang. methicillin-resistant Staphylococcus aureus - MRSA). To właśnie na jego badaniu skupiła się uwaga dr hab. Elżbiety Kołaczkowskiej z UJ. Wraz z zespołem badaczy z Uniwersytetu w Calgary, kierowanym przez prof. Paula Kubesa, zaproponowała ona nowy model badań mechanizmów rozwoju zakażania wywołanego przez MRSA. Idea ta okazała się na tyle interesująca, że tekst na jej temat opublikowało ważne w dziedzinach związanych z naukami biologiczno-medycznymi czasopismo „Nature Communications" (Impact Factor 10,742).
Wyjątkowość tego modelu polega m.in. na tym, że w badaniach zastosowano mikroskopię in vivo (intravital microscopy), czyli metodę mikroskopowego obserwowania zjawisk zachodzących wewnątrz żywego organizmu w czasie rzeczywistym. Krótko mówiąc, dzięki tej metodzie zjawiska zachodzące wewnątrz organizmu (np. przepływ krwinek w naczyniach krwionośnych) rozgrywają się na naszych oczach. Możemy je także nagrać (cyfrowe filmy video), a potem mierzyć różne parametry przy pomocy specjalistycznego oprogramowania i porównywać jak wyglądają one u osobników zdrowych, a jak u tych chorych. Dzięki temu możemy poznać „niewidoczne" dotychczas zmiany czy zachowania np. komórek odpornościowych walczących z bakteriami. A ich poznanie mogłoby umożliwić skuteczniejsze leczenie i zapobieganie uszkodzeń narządów u chorych z sepsą.
Neutrofile zarzucają sieci
Elżbieta Kołaczkowska i Paul Kubes skoncentrowali się w swoich badaniach na niedawno poznanym mechanizmie eliminowania patogenów przez neutrofile. Neutrofile to jeden z typów białych krwinek (leukocytów). Dziesięć lat temu odkryto nowy mechanizm walki neutrofilii z patogenami polegający na tworzeniu zewnątrzkomórkowych sieci neutrofilowych (NET, ang. Neutrophil Extracellular Traps). NET są wyrzucane z neutrofilii i działają podobnie do sieci rybackich czy pajęczych, mają za zadanie złapanie bakterii, ich unieszkodliwienie oraz, dodatkowo, zabicie. NET są utworzone z zdekondensowanego (a więc nieupakowanego, a rozwiniętego) DNA komórki, które stanowi szkielet sieci (podobnie jak rozpięta pajęczyna), do którego przyczepione są enzymy i białka przeciwbakteryjnie, które normalnie znajdują się wewnątrz neutrofila (rycina).
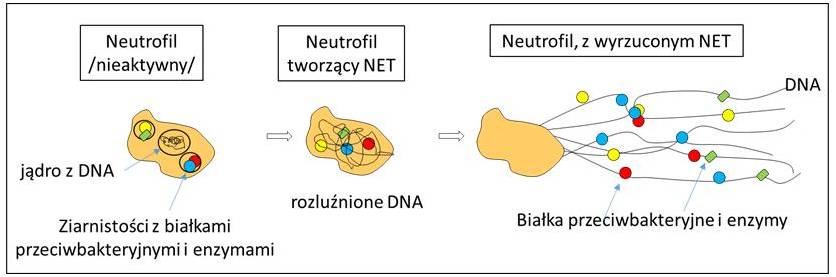
W swoich badaniach Kołaczkowska i Kubes wykazali, że takie NET są wyrzucone przez neutrofil również w czasie sepsy wywołanej przez gronkowca złocistego opornego na antybiotyki. Okazało się, że choć NET są wytwarzane w celu zneutralizowania bakterii MRSA zaraz po infekcji, nie są potem skutecznie usuwane i pozostają w naczyniach krwionośnych przez wiele godzin po wyeliminowaniu bakterii. Niektóre ich składowe, takie jak enzym elastaza neutrofilowa, powodują uszkodzenia komórek wątroby, prowadząc w konsekwencji do poważnej niesprawności tego narządu.
„Kiedy jednak usunęliśmy NET, a przede wszystkim, kiedy nie dopuściliśmy do ich wytworzenia przez neutrofile, wątroba nie ulegała uszkodzeniu" – informuje dr hab. Elżbieta Kołaczkowska. Wyniki te jednoznacznie wskazują, że NET mają również swoją ciemną stronę, mogą niszczyć nasze własne narządy.
Jak więc je usuwać, bądź nie dopuszczać do ich tworzenia? Próbując odpowiedzieć na to pytanie, badania Kołaczkowskiej i Kubesa skoncentrowały się na enzymie deoksyrybonukleazy (DNaza), który tnie DNA na drobne fragmenty, na tyle niewielkie, że nie są już w stanie utworzyć przestrzennej sieci. Dotychczas uważano, że ponieważ DNA stanowi szkielet NET, pocięcie go przy pomocy podanej dożylnie DNazy usunie skutecznie cały NET. Takie wyniki istotnie uzyskano w badaniach in vitro, a więc na pojedynczych komórkach hodowanych w próbówce. Bardzo trudno było jednak zweryfikować tę hipotezę w żywych organizmach. Umożliwiło to dopiero zastosowanie mikroskopii in vivo na modelach zwierzęcych (myszy laboratoryjne).
„Ku swemu zaskoczeniu zaobserwowaliśmy, że choć DNaza całkowicie usuwa DNA, to pozostałe cząsteczki przyczepione do NET, w tym elastaza neutrofilowa, są tylko częściowo przez nią odrywane od naczyń krwionośnych. W konsekwencji, użycie DNazy nie chroni przed uszkodzeniem wątroby." – podkreśla badaczka z Krakowa.
W serii kolejnych eksperymentów, dr hab. Kołaczkowska i prof. Kubes wykazali, że wynika to z faktu, iż elementy NET, w naczyniach krwionośnych żywych osobników, wiążą się z białkami pokrywającymi od wewnątrz ściany naczyń krwionośnych, już bez udziału DNA. Tak więc metoda z użyciem DNazy nie sprawdza się do usuwania całych sieci NET. Obecnie najbardziej obiecujące w zapobieganiu tworzenia się NET wydają się substancje hamujące (inhibitory) tworzenie enzymów, takich jak PAD4 (deaminaza 4 peptydylo argininy). Zespoły Kołaczkowskiej i Kubsa testują obecnie inhibitory PAD4 przy pomocy mikroskopii in vivo.
- Artykuł opublikowany w Nature Communications:
Kolaczkowska E, Jenne CN, Surewaard BG, Thanabalasuriar A, Lee WY, Sanz MJ, Mowen K, Opdenakker G, Kubes P. Molecular mechanisms of NET formation and degradation revealed by intravital imaging in the liver vasculature. Nat Commun. 2015 Mar 26;6:6673. doi: 10.1038/ncomms7673.
- Artkuł jest dostępny za darmo online (Open Access) wraz z filmami video (Supplementary information): http://www.nature.com/ncomms/2015/150326/ncomms7673/full/ncomms7673.html
Dr hab. Elżbieta Kołaczkowska jest adiunktem w Zakładzie Immunologii Ewolucyjnej w Instytucie Zoologii UJ. Jest immunologiem, zajmuje się odpornością wrodzoną organizmów, w tym NET – zewnątrzkomórkowymi sieciami neutrofilowymi. Opublikowała ponad 40 artykułów badawczych w czasopismach naukowych, w tym w „Nature Reviews Immunology", „Journal of Experimental Medicine", „Nature Communications".
Absolwentka UJ (1996), stopień doktora otrzymała na Uniwersytecie w Tromso w Norwegii (2001), zaś habilitację uzyskała na Uniwersytecie Jagiellońskim w 2011 roku. Jest dwukrotną stypendystką Fundacji na Rzecz Nauki Polskiej (program START) oraz stypendium Funduszu im. Adama Krzyżanowskiego. Otrzymała także kilka nagród Rektora UJ, oraz nagrody za prezentacje na międzynarodowych konferencjach naukowych oraz publikacje (np. Nagrodę im. Wacława Mayzla za najlepszy artykuł opublikowany w Postępach Biologii Komórki). Odbyła staże na Uniwersytecie w Tokio (prestiżowe stypendium przyznane przez Japan Society for the Promotion of Science), Niemczech (Niemieckie Centrum Badań nad Nowotworami w Heidelbergu), Holandii (Uniwersytet w Wageningen) i Hiszpanii (Uniwersytet Kraju Basków w Bilbao/Leoia). Była też stypendystką programu Marie Curie, prestiżowego stypendium Unii Europejskiej przeznaczonego dla Europejskich naukowców na prowadzenie badań poza krajem zamieszkania. W ramach tego stypendium dr hab. Kołaczkowska odbyła dwuletni staż na Uniwersytecie w Calgary w Kanadzie oraz roczny na Katolickim Uniwersytecie w Leuven w Belgii. W trakcie pobytu w Kanadzie pracowała w laboratorium prof. Paul Kubesa, w którym prowadziła badania z wykorzystaniem mikroskopii in vivo (intravital microscopy), unikatowej metody pozwalającej na przeprowadzanie obserwacji wewnątrz żywych organizmów.


![Pszczoły na diecie? [wideo]](/documents/74541952/147053668/bee2_230x300.png/132b8ed5-2598-4f5d-a105-c565636e3911?t=1616428310238)